■ブログの趣旨はこちらの記事を確認のこと。 http://english123.blog.shinobi.jp/%E9%9B%91%E8%A8%98/%E3%83%96%E3%83%AD%E3%82%B0%E3%81%AB%E3%81%A4%E3%81%84%E3%81%A6
ある社会人の勉強記録
[PR]
×
[PR]上記の広告は3ヶ月以上新規記事投稿のないブログに表示されています。新しい記事を書く事で広告が消えます。
カルノーの定理の証明とクラウジウスの不等式導入
■カルノーの定理の証明
前回、カルノーサイクルの概要と効率の計算の仕方を論じました。
今回はもう少し議論を発展させて、カルノーの定理について論じます。カルノーの定理の前に一つ論じておくことがあります。それは、カルノーサイクルが可逆か不可逆かです。カルノーサイクルは、結論からいうと可逆機関です。そもそも、カルノーサイクル自体が可逆過程を組み合わせたものであり、逆に回すことも可能なのです。そこを踏まえたうえでカルノーの定理を考えてみましょう。カルノーの定理とは、下記の定理です。
■定まった高温熱源と低温熱源の間に働く熱機関サイクルのうち、全ての可逆サイクルは等しく最大であり、不可逆サイクルは必ずそれより小さい。
何の話をしているかというと、こういうことです。「高温熱源と低温熱源がある熱機関だとカルノーサイクル(可逆サイクル)は全部同じ効率であり、カルノーサイクルが最大効率を持ったサイクルです。よって、不可逆サイクルはそれより効率が低くなります」といっているのです。
よく、オットーサイクルやランキンサイクル等の実サイクルも可逆サイクルだから、カルノーの定理よりカルノーサイクルと同じ効率では?と思われる方がいる。そもそも前提である熱源の個数がずれています。カルノーの定理は【ただ2つの熱源の間で動作する可逆機関】を対象として議論をしています。でも、実サイクルはそうではありません。例えば、実サイクルの可逆機関では等圧変化過程や等積変化過程があります。これらの過程では必ず熱の出入りがあります。準静的変化(可逆変化)では,熱の移動の時に温度差があってはいけませんから例えば等圧変化で温度が Ta から Tb まで変化したとすると,熱をやりとりする相手の熱源は温度が Ta から Tb までの連続無限個のものが必要になります.
したがって,カルノーサイクル以外のものは【ただ2つの熱源の間で動作する可逆機関】ではないのです。ここは誤解しないでください。同じディスカッションがYahoo知恵袋にありますので紹介しておきます。
http://okwave.jp/qa/q5374013.html
じゃあ、何故カルノーの定理が成り立つのか。今回はこれについて解説しようと思います。
すべての可逆サイクル(カルノーサイクル)の効率は等しい。
(証明)可逆サイクルAと可逆サイクルBの効率をηAとηBを定義する。今、ηA>ηBだと仮定しサイクルAとサイクルBを連結したサイクルを考える。(下図参考)
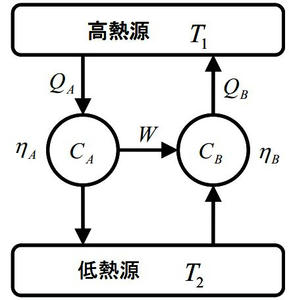
上のサイクルではηA>ηBより、W/QA > W/QB ⇔QB > QAとなるが、この場合低温熱源から高温熱源に移動することになり、熱力学の第二法則に反する。よってηA≦Bでなければならない。
※そもそも可逆サイクル同士の組み合わせですから、このケースの場合、何の影響も残さずに低温熱源から高温熱源に熱を移動させていますよね。
じゃあ、ηA<ηBとなる場合はどうかというと、下記の図を見てください。
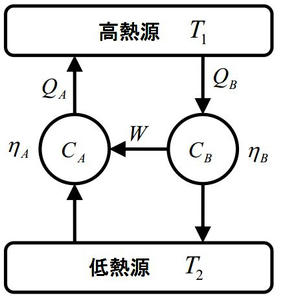
図のように可逆サイクルを回すとηA<ηB⇔W/QA<W/QB⇔QB<QAとなり、低温熱源から高温熱源に何の影響も残さず可逆的に熱の移動ができてしまう。これもまた矛盾だといえます。
二つの熱源の場合、可逆機関の熱効率はηA=ηBとなり等しくならざるをえないのです。
不可逆サイクルの効率は必ず可逆サイクル(カルノーサイクル)に劣る。
これを証明するために、可逆サイクルと不可逆サイクルを組み合わせた図のようなサイクルを考えましょう。

不可逆サイクルの効率をη’、可逆サイクルの効率をηとする。
η’>ηと仮定すると、W/Q'>W/Q⇔Q>Q'となり、やはり熱力学第二法則に矛盾する。よってη’≦ηとなる。更にη’=ηとするとQ'=Qとなるが、これでは不可逆サイクルと可逆サイクルの連結サイクルが可逆サイクルになってしまうので矛盾しています。以上より、η’<ηとならざるをえないのです。
これにより二つの熱源からなる可逆サイクル(カルノーサイクル)こそが、最大の熱効率を誇る熱機関だということが証明されました。更に、カルノー効率は前回の記事によると
η = 1- TL/TH = (TH - TL)/TH < 1です。
従って、η=1となる熱機関は作ることができないのです。第二種永久機関は存在しない。カルノーの功績から定量的に理解できると思います。それにもかかわらず、カルノー自身は熱力学第二法則の発見者ではないのですよね。それでも、物理学が進んだ現代だからカルノーの功績の素晴らしさは理解できるものだと思いますよ。
追記:実はこれまで理想気体でカルノー効率を定義したので、腑に落ちないかもしれませんがやはり実在気体であっても上のような効率になります。やはりすべてのカルノーサイクルは同等なのです。これを導出するヒントは、http://qanda.rakuten.ne.jp/qa1885802.htmlに論じられていますが、暇な時やっておきます。
■クラウジウスの不等式
さて、ここまで二つの熱源に対して下記が成り立つことを論じました。
QH/TH + QL/TL = 0 …①
不可逆過程の場合は、上の=が成り立ちません。カルノーの定理より
η = W/QH = (QH+QL)/QH < (TH - TL)/TH
⇔1 + QL/QH < 1 - TL/TH
⇔QL/QH + TL/TH < 0
⇔QL/TL + TH/QH <0…②
となります。従って一般の機関に対して下記が成り立つのは自明です。
QH/TH + QL/TL ≦ 0 …③
さて、2個の熱源で上の式が成り立つことがわかりました。
これをN個の熱源に拡張した議論がクラウジウスの不等式です。
クラウジウスの不等式では複数個の熱源に対して下記が成り立つという議論です。
ΣQi/Ti ≦0(∞個の熱源に拡張すると∮dQ/T≦0)
では、何故この式が成り立つのか?次回の記事ではそれについて論じようと思います。
前回、カルノーサイクルの概要と効率の計算の仕方を論じました。
今回はもう少し議論を発展させて、カルノーの定理について論じます。カルノーの定理の前に一つ論じておくことがあります。それは、カルノーサイクルが可逆か不可逆かです。カルノーサイクルは、結論からいうと可逆機関です。そもそも、カルノーサイクル自体が可逆過程を組み合わせたものであり、逆に回すことも可能なのです。そこを踏まえたうえでカルノーの定理を考えてみましょう。カルノーの定理とは、下記の定理です。
■定まった高温熱源と低温熱源の間に働く熱機関サイクルのうち、全ての可逆サイクルは等しく最大であり、不可逆サイクルは必ずそれより小さい。
何の話をしているかというと、こういうことです。「高温熱源と低温熱源がある熱機関だとカルノーサイクル(可逆サイクル)は全部同じ効率であり、カルノーサイクルが最大効率を持ったサイクルです。よって、不可逆サイクルはそれより効率が低くなります」といっているのです。
よく、オットーサイクルやランキンサイクル等の実サイクルも可逆サイクルだから、カルノーの定理よりカルノーサイクルと同じ効率では?と思われる方がいる。そもそも前提である熱源の個数がずれています。カルノーの定理は【ただ2つの熱源の間で動作する可逆機関】を対象として議論をしています。でも、実サイクルはそうではありません。例えば、実サイクルの可逆機関では等圧変化過程や等積変化過程があります。これらの過程では必ず熱の出入りがあります。準静的変化(可逆変化)では,熱の移動の時に温度差があってはいけませんから例えば等圧変化で温度が Ta から Tb まで変化したとすると,熱をやりとりする相手の熱源は温度が Ta から Tb までの連続無限個のものが必要になります.
したがって,カルノーサイクル以外のものは【ただ2つの熱源の間で動作する可逆機関】ではないのです。ここは誤解しないでください。同じディスカッションがYahoo知恵袋にありますので紹介しておきます。
http://okwave.jp/qa/q5374013.html
じゃあ、何故カルノーの定理が成り立つのか。今回はこれについて解説しようと思います。
すべての可逆サイクル(カルノーサイクル)の効率は等しい。
(証明)可逆サイクルAと可逆サイクルBの効率をηAとηBを定義する。今、ηA>ηBだと仮定しサイクルAとサイクルBを連結したサイクルを考える。(下図参考)
上のサイクルではηA>ηBより、W/QA > W/QB ⇔QB > QAとなるが、この場合低温熱源から高温熱源に移動することになり、熱力学の第二法則に反する。よってηA≦Bでなければならない。
※そもそも可逆サイクル同士の組み合わせですから、このケースの場合、何の影響も残さずに低温熱源から高温熱源に熱を移動させていますよね。
じゃあ、ηA<ηBとなる場合はどうかというと、下記の図を見てください。
図のように可逆サイクルを回すとηA<ηB⇔W/QA<W/QB⇔QB<QAとなり、低温熱源から高温熱源に何の影響も残さず可逆的に熱の移動ができてしまう。これもまた矛盾だといえます。
二つの熱源の場合、可逆機関の熱効率はηA=ηBとなり等しくならざるをえないのです。
不可逆サイクルの効率は必ず可逆サイクル(カルノーサイクル)に劣る。
これを証明するために、可逆サイクルと不可逆サイクルを組み合わせた図のようなサイクルを考えましょう。
不可逆サイクルの効率をη’、可逆サイクルの効率をηとする。
η’>ηと仮定すると、W/Q'>W/Q⇔Q>Q'となり、やはり熱力学第二法則に矛盾する。よってη’≦ηとなる。更にη’=ηとするとQ'=Qとなるが、これでは不可逆サイクルと可逆サイクルの連結サイクルが可逆サイクルになってしまうので矛盾しています。以上より、η’<ηとならざるをえないのです。
これにより二つの熱源からなる可逆サイクル(カルノーサイクル)こそが、最大の熱効率を誇る熱機関だということが証明されました。更に、カルノー効率は前回の記事によると
η = 1- TL/TH = (TH - TL)/TH < 1です。
従って、η=1となる熱機関は作ることができないのです。第二種永久機関は存在しない。カルノーの功績から定量的に理解できると思います。それにもかかわらず、カルノー自身は熱力学第二法則の発見者ではないのですよね。それでも、物理学が進んだ現代だからカルノーの功績の素晴らしさは理解できるものだと思いますよ。
追記:実はこれまで理想気体でカルノー効率を定義したので、腑に落ちないかもしれませんがやはり実在気体であっても上のような効率になります。やはりすべてのカルノーサイクルは同等なのです。これを導出するヒントは、http://qanda.rakuten.ne.jp/qa1885802.htmlに論じられていますが、暇な時やっておきます。
■クラウジウスの不等式
さて、ここまで二つの熱源に対して下記が成り立つことを論じました。
QH/TH + QL/TL = 0 …①
不可逆過程の場合は、上の=が成り立ちません。カルノーの定理より
η = W/QH = (QH+QL)/QH < (TH - TL)/TH
⇔1 + QL/QH < 1 - TL/TH
⇔QL/QH + TL/TH < 0
⇔QL/TL + TH/QH <0…②
となります。従って一般の機関に対して下記が成り立つのは自明です。
QH/TH + QL/TL ≦ 0 …③
さて、2個の熱源で上の式が成り立つことがわかりました。
これをN個の熱源に拡張した議論がクラウジウスの不等式です。
クラウジウスの不等式では複数個の熱源に対して下記が成り立つという議論です。
ΣQi/Ti ≦0(∞個の熱源に拡張すると∮dQ/T≦0)
では、何故この式が成り立つのか?次回の記事ではそれについて論じようと思います。
PR
シャルピー衝撃試験
シャルピー衝撃試験とは,ハンマで試験片を打撃して破壊し,打撃後のハンマの振り上げ角度を読み取って試験片の破壊に費やされたエネルギーを求める試験です。試験機は振り子式で、振り子の先端についたハンマーが試験片に衝突し、試験片を破壊するときの衝撃エネルギーを読み取ります。これは、振り子の振り下ろす前の位置エネルギーと試験片破壊後に残された振り子のエネルギーの差となっています。
実際のエネルギーの計算式は下記を参考にしてください。↓
http://detail.chiebukuro.yahoo.co.jp/qa/question_detail/q1096909315
ここでは、シャルピー衝撃試験の動画をいくつか紹介しましょう。
実際のエネルギーの計算式は下記を参考にしてください。↓
http://detail.chiebukuro.yahoo.co.jp/qa/question_detail/q1096909315
ここでは、シャルピー衝撃試験の動画をいくつか紹介しましょう。
カルノーサイクル入門:理想気体のカルノー効率について
カルノーサイクルの熱力学的な意味はさておき、まずはどんなサイクルなのか紹介しようと思います。下記画像をご覧ください。

状態A,B,C,DをそれぞれA(Pa,Va,Ta),B(Pb,Vb,Tb),C(Pc,Vc,Tc),D(Pd,Vd,Td)とします。
カルノーサイクルの場合、下記のような4つの可逆変化を行うサイクルとなっています。
A⇒B:等温膨張
B⇒C:断熱膨張
C⇒D:等温圧縮
D⇒A:断熱圧縮
入力した熱量Qin、外部にしたトータルの仕事Wtを用いて熱機関の効率ηは一般的にη= Wt/Qinとなります。本日の議題は理想気体でカルノーサイクルにおける効率ηを計算してみようということです。(カルノーサイクルにおける効率をカルノー効率といいます。)小難しいことは考えず一個一個のプロセスで熱力学の第一法則を立ててみましょう。
■A⇒B:等温膨張
ΔUab = Qab + Wab …①
等温なので、Ta = Tb。また理想気体だとΔUab=0となる。よって
Qab= -Wab = ∫PdV = nRTa*dV/V = nRTa*Ln(Vb/Va)…②
■B⇒C:断熱膨張
ΔUbc = Qbc + Wbc …③
断熱過程なのでQbc = 0となる。従って、
Wbc = U(Tc) - U(Tb) = U(Tc) - U(Ta) … ④
■C⇒D:等温圧縮
ΔUcd = Qcd + Wcd …⑤
等温なので、Tc = Td。また理想気体だとΔUcd=0となる。よって
Qcd= -Wcd = ∫PdV = nRTc*dV/V = nRTc*Ln(Vd/Vc)…⑥
■D⇒A:断熱圧縮
ΔUda = Qda + Wda …⑦
断熱過程なのでQbc = 0となる。従って、
Wda = U(Ta) - U(Td) = U(Ta) - U(Tc) … ⑧
以上より、正味の仕事Wtは④、⑧を代入すると次式のようになる。
Wt = -(Wab + Wbc + Wcd + Wda) = -(Wab + Wcd) = Qab + Qcd
よって、熱効率ηはQin = Qabとなるので次式の通りになる。
η = (Qab + Qcd)/Qab = 1 + Qcd/Qab…⑨
大分本質的な形になりましたね。
QcdとQabに②式と⑥式を代入しましょう。すると、
η = 1 + (Tc/Ta)*Ln(Vb/Va)/{Ln(Vd/Vc)}…⑩
ここで、ポアソンの関係式を思い出すと下記が成り立ちます。
Vb^(γ‐1)*Tb = Vb^(γ‐1)*Ta = Vc^(γ‐1)*Tc…⑪
Vd^(γ‐1)*Td = Vd^(γ‐1)*Tc = Va^(γ‐1)*Ta…⑫
⑪×⑫⇔(Vb*Vd)^(γ‐1) = (Va*Vc)^(γ‐1) …⑬
∴Vb*Vd= Va*Vc ⇔ Vb/Va = Vc/Vd…⑬'
⑬’を⑩に代入すると、下記のようになります。
η = 1 + Qcd/Qab =1 - (Tc/Ta) …⑭
ここで、おさらい。Qabは高温熱源からの熱源を表していますのでQH,Qcdは低温熱源からの熱を表していますのでQLと書くことにします。またTa、Tcも同様にTH,TLと表記します。世の一般的な教科書では、下記のように書くほうが一般的かもしれません。
η = 1 + QL/QH =1 - (TL/TH) …⑭’
更に、⑭式を見てわかるようにカルノーサイクルでは下記の式が成り立ちます。
QL/QH = -(TL/TH)
QL/TL + QH/TL = 0…⑮
この⑮式こそ、エントロピーの発見につながる重要な式なのです。この話はのちにクラウジウスの不等式の話でします。カルノーサイクルとカルノー効率はここまでです。
状態A,B,C,DをそれぞれA(Pa,Va,Ta),B(Pb,Vb,Tb),C(Pc,Vc,Tc),D(Pd,Vd,Td)とします。
カルノーサイクルの場合、下記のような4つの可逆変化を行うサイクルとなっています。
A⇒B:等温膨張
B⇒C:断熱膨張
C⇒D:等温圧縮
D⇒A:断熱圧縮
入力した熱量Qin、外部にしたトータルの仕事Wtを用いて熱機関の効率ηは一般的にη= Wt/Qinとなります。本日の議題は理想気体でカルノーサイクルにおける効率ηを計算してみようということです。(カルノーサイクルにおける効率をカルノー効率といいます。)小難しいことは考えず一個一個のプロセスで熱力学の第一法則を立ててみましょう。
■A⇒B:等温膨張
ΔUab = Qab + Wab …①
等温なので、Ta = Tb。また理想気体だとΔUab=0となる。よって
Qab= -Wab = ∫PdV = nRTa*dV/V = nRTa*Ln(Vb/Va)…②
■B⇒C:断熱膨張
ΔUbc = Qbc + Wbc …③
断熱過程なのでQbc = 0となる。従って、
Wbc = U(Tc) - U(Tb) = U(Tc) - U(Ta) … ④
■C⇒D:等温圧縮
ΔUcd = Qcd + Wcd …⑤
等温なので、Tc = Td。また理想気体だとΔUcd=0となる。よって
Qcd= -Wcd = ∫PdV = nRTc*dV/V = nRTc*Ln(Vd/Vc)…⑥
■D⇒A:断熱圧縮
ΔUda = Qda + Wda …⑦
断熱過程なのでQbc = 0となる。従って、
Wda = U(Ta) - U(Td) = U(Ta) - U(Tc) … ⑧
以上より、正味の仕事Wtは④、⑧を代入すると次式のようになる。
Wt = -(Wab + Wbc + Wcd + Wda) = -(Wab + Wcd) = Qab + Qcd
よって、熱効率ηはQin = Qabとなるので次式の通りになる。
η = (Qab + Qcd)/Qab = 1 + Qcd/Qab…⑨
大分本質的な形になりましたね。
QcdとQabに②式と⑥式を代入しましょう。すると、
η = 1 + (Tc/Ta)*Ln(Vb/Va)/{Ln(Vd/Vc)}…⑩
ここで、ポアソンの関係式を思い出すと下記が成り立ちます。
Vb^(γ‐1)*Tb = Vb^(γ‐1)*Ta = Vc^(γ‐1)*Tc…⑪
Vd^(γ‐1)*Td = Vd^(γ‐1)*Tc = Va^(γ‐1)*Ta…⑫
⑪×⑫⇔(Vb*Vd)^(γ‐1) = (Va*Vc)^(γ‐1) …⑬
∴Vb*Vd= Va*Vc ⇔ Vb/Va = Vc/Vd…⑬'
⑬’を⑩に代入すると、下記のようになります。
η = 1 + Qcd/Qab =1 - (Tc/Ta) …⑭
ここで、おさらい。Qabは高温熱源からの熱源を表していますのでQH,Qcdは低温熱源からの熱を表していますのでQLと書くことにします。またTa、Tcも同様にTH,TLと表記します。世の一般的な教科書では、下記のように書くほうが一般的かもしれません。
η = 1 + QL/QH =1 - (TL/TH) …⑭’
更に、⑭式を見てわかるようにカルノーサイクルでは下記の式が成り立ちます。
QL/QH = -(TL/TH)
QL/TL + QH/TL = 0…⑮
この⑮式こそ、エントロピーの発見につながる重要な式なのです。この話はのちにクラウジウスの不等式の話でします。カルノーサイクルとカルノー効率はここまでです。
中国産ガムロジン急騰
化学工業日報によると、ここ最近中国産ガムロジンが値上がりしています。
■ニュースの詳細
2013年10月04日 「化学工業日報」
中国産ガムロジン急騰 一時トン当たり約2800ドル
中国産ガムロジンが急騰している。足元の相場は一時1トン当たり2800ドル近辺に急上昇。2013年8月に同2000ドルに達した取引価格は短期間でさらに800ドル程度値上がりした。中国国内景気を映し需要は精彩を欠くものの、上昇の背景に「玉不足と仲介人による在庫調整」(市場関係者)が挙げられている。中国産ガムロジンの急騰により日本のロジン関連産業への打撃が懸念されている。
さてガムロジンですがロジンについては、よくわからない方も多いと思います。
これについては、荒川化学工業のHPに詳細が書いてあります。
■荒川化学工業のHPについて
http://www.arakawachem.co.jp/jp/technology/catalog/01.html
ロジンは松から得られる琥珀色、無定形の天然樹脂です。その主成分は、3つの環構造、共役2重結合、カルボキシル基を有するアビエチン酸とその異性体の混合物であり、反応性に富んだバルキーな構造を有しています。 ロジンの持つこれらの反応性を利用して、多くの誘導体がそれぞれの物性を発揮、工業用原料として広く産業界で使用されており、弊社は国内最大のサプライヤーとなっています。
産業界で広く使用されているとのことですが、用途がよくわからない。
そこで調べてみると、具体的な用途についてはハリマ化成グループが紹介しています
■ハリマ化成グループのHPについて
http://www.harima.co.jp/pine_chemicals/rosin2.html
なるほど。結構用途が広いのですね。こういったものが値上がりするリスクがあるということなのだろうか?
■ニュースの詳細
2013年10月04日 「化学工業日報」
中国産ガムロジン急騰 一時トン当たり約2800ドル
中国産ガムロジンが急騰している。足元の相場は一時1トン当たり2800ドル近辺に急上昇。2013年8月に同2000ドルに達した取引価格は短期間でさらに800ドル程度値上がりした。中国国内景気を映し需要は精彩を欠くものの、上昇の背景に「玉不足と仲介人による在庫調整」(市場関係者)が挙げられている。中国産ガムロジンの急騰により日本のロジン関連産業への打撃が懸念されている。
さてガムロジンですがロジンについては、よくわからない方も多いと思います。
これについては、荒川化学工業のHPに詳細が書いてあります。
■荒川化学工業のHPについて
http://www.arakawachem.co.jp/jp/technology/catalog/01.html
ロジンは松から得られる琥珀色、無定形の天然樹脂です。その主成分は、3つの環構造、共役2重結合、カルボキシル基を有するアビエチン酸とその異性体の混合物であり、反応性に富んだバルキーな構造を有しています。 ロジンの持つこれらの反応性を利用して、多くの誘導体がそれぞれの物性を発揮、工業用原料として広く産業界で使用されており、弊社は国内最大のサプライヤーとなっています。
産業界で広く使用されているとのことですが、用途がよくわからない。
そこで調べてみると、具体的な用途についてはハリマ化成グループが紹介しています
■ハリマ化成グループのHPについて
http://www.harima.co.jp/pine_chemicals/rosin2.html
なるほど。結構用途が広いのですね。こういったものが値上がりするリスクがあるということなのだろうか?
Q6:昨日ゴロゴロしていました⇒英語でなんというか。
答え:I was chilling out yesterday.
chill out ⇒ごろごろするとか落ち着く、くつろぐという意味です。他にもごろごろするという表現はいくつかあります。veg outという表現もごろごろするです。I was vegging out yeseterday.という表現も日常会話ではよく使います。他にも例文をあげておきますね。
Yesterday, I was chilling out with my girl friend.
And then , I was so happy because I was necking with her.
昨日、彼女とごろごろしていました。
その時、私はとても幸せでした。
何故なら、彼女と抱き合ってキスしていたからです。
: neck ⇒俗語で抱きあってキスするという意味です。
本日はここまで。
chill out ⇒ごろごろするとか落ち着く、くつろぐという意味です。他にもごろごろするという表現はいくつかあります。veg outという表現もごろごろするです。I was vegging out yeseterday.という表現も日常会話ではよく使います。他にも例文をあげておきますね。
Yesterday, I was chilling out with my girl friend.
And then , I was so happy because I was necking with her.
昨日、彼女とごろごろしていました。
その時、私はとても幸せでした。
何故なら、彼女と抱き合ってキスしていたからです。
: neck ⇒俗語で抱きあってキスするという意味です。
本日はここまで。
忍者カウンター
カレンダー
カテゴリー
フリーエリア
最新記事
(04/05)
(01/18)
(01/18)
(01/18)
(01/18)
プロフィール
HN:
こうちゃん。
性別:
非公開
ブログ内検索
最古記事
(01/24)
(09/07)
(09/07)
(09/12)
(09/12)

