■ブログの趣旨はこちらの記事を確認のこと。 http://english123.blog.shinobi.jp/%E9%9B%91%E8%A8%98/%E3%83%96%E3%83%AD%E3%82%B0%E3%81%AB%E3%81%A4%E3%81%84%E3%81%A6
ある社会人の勉強記録
[PR]
×
[PR]上記の広告は3ヶ月以上新規記事投稿のないブログに表示されています。新しい記事を書く事で広告が消えます。
2成分系状態図‐ベンゼン‐トルエン
ベンゼンのモル分率をx1,蒸気圧をP1とする。
トルエンのモル分率をx2,蒸気圧をP2とする。
ここで、モル分率の定義より2成分系では次式が成り立つ。
x1+x2 = 1 …①
さらに、全蒸気圧をPとしてドルトンの分圧の法則より、分圧について次式が成り立つ。
P = P1+P2…②
ここで、理想溶液ではラウールの法則が成り立つので、任意の成分iに対して次式が成り立つ。
Pi = pi*xi …③
piは純物質における蒸気圧である。この式を用いて②式を変形すると、
P = p1*x1+p2*x2 = p1*x1+p2*(1-x1) = (p1-p2)*x1 + p2 …④
あるいは、
P = p1*x1+p2*x2 = p1*(1-x2)+p2*x2 = (p2-p1)*x2 + p1…⑤
と変形できる。ここで、ベンゼンとトルエンの純物質時の蒸気圧は20℃でそれぞれ
75.0、27.0 Torrであり、代入すると下記の式のようになる。
P=48x1+27.0 …④’
P=75-48x2 …⑤’
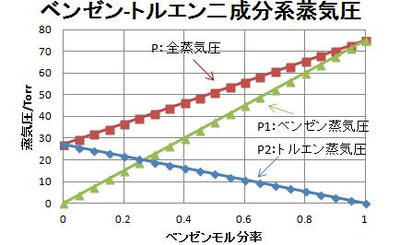
ベンゼンのモル分率x1に対して、P,P1,P2をプロットしたのが下の図である。
最後に蒸気になった分子のモル数を求めておこう。
ベンゼン、トルエンの蒸気中のモル数をy1,y2とするとドルトンの分圧の法則より
y1 = P1/P = p1x1/{ (p1-p2)*x1 + p2 } = 75x1/(48x1+27.0)…⑥
y2 = P2/P = p2x2/{(p2-p1)*x2 + p1} = 27x2/(75-48x2)…⑦
以上より、液相中のベンゼンモル分率x1と蒸気圧P,蒸気中のベンゼンモル分率y1とPをプロットしたグラフが下の図である。前者を液相線、後者を気相線という。

以上が状態図の入門である。
トルエンのモル分率をx2,蒸気圧をP2とする。
ここで、モル分率の定義より2成分系では次式が成り立つ。
x1+x2 = 1 …①
さらに、全蒸気圧をPとしてドルトンの分圧の法則より、分圧について次式が成り立つ。
P = P1+P2…②
ここで、理想溶液ではラウールの法則が成り立つので、任意の成分iに対して次式が成り立つ。
Pi = pi*xi …③
piは純物質における蒸気圧である。この式を用いて②式を変形すると、
P = p1*x1+p2*x2 = p1*x1+p2*(1-x1) = (p1-p2)*x1 + p2 …④
あるいは、
P = p1*x1+p2*x2 = p1*(1-x2)+p2*x2 = (p2-p1)*x2 + p1…⑤
と変形できる。ここで、ベンゼンとトルエンの純物質時の蒸気圧は20℃でそれぞれ
75.0、27.0 Torrであり、代入すると下記の式のようになる。
P=48x1+27.0 …④’
P=75-48x2 …⑤’
ベンゼンのモル分率x1に対して、P,P1,P2をプロットしたのが下の図である。
最後に蒸気になった分子のモル数を求めておこう。
ベンゼン、トルエンの蒸気中のモル数をy1,y2とするとドルトンの分圧の法則より
y1 = P1/P = p1x1/{ (p1-p2)*x1 + p2 } = 75x1/(48x1+27.0)…⑥
y2 = P2/P = p2x2/{(p2-p1)*x2 + p1} = 27x2/(75-48x2)…⑦
以上より、液相中のベンゼンモル分率x1と蒸気圧P,蒸気中のベンゼンモル分率y1とPをプロットしたグラフが下の図である。前者を液相線、後者を気相線という。
以上が状態図の入門である。
PR
忍者カウンター
カレンダー
カテゴリー
フリーエリア
最新記事
(04/05)
(01/18)
(01/18)
(01/18)
(01/18)
プロフィール
HN:
こうちゃん。
性別:
非公開
ブログ内検索
最古記事
(01/24)
(09/07)
(09/07)
(09/12)
(09/12)


COMMENT